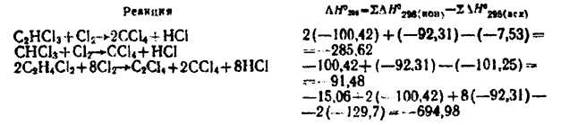|
Курсовая работа: Производство тетрахлорметана и тетрахлорэтиленаКурсовая работа: Производство тетрахлорметана и тетрахлорэтиленаМИНИСТЕРСТВО ОБРАЗОВАНИЯ РЕСПУБЛИКИ БЕЛАРУСЬ Учереждение образования «Белорусский государственный технологический университет» Факультет инженерно-экономическийКафедра технологии нефтехимического синтеза и переработки полимерных материаловРАСЧЕТНО-ПОЯСНИТЕЛЬНАЯ ЗАПИСКА к курсовому проекту по курсу: «Технология и оборудование основного органического и нефтехимического синтеза» на тему:«Производство тетрахлорметана и тетрахлорэтилена мощностью 40000 т/год» Разработал: студент 3 курса 1 гр. Жиренков М.В. Проверил: ст. преп. Юсевич А.И. Минск 2006 г. РЕФЕРАТ Пояснительная записка содержит 45 стр., 7 рис., 6 табл., 8 литературных источников, 1 лист графического материала формата А1. Тетрахлорметан, Тетрахлорэтилен, хлорирование, хлоратор, хлороводород, перхлоруглеводород. Цель работы – изучить производство тетрахлорметана и тетрахлорэтилена. Объект проектирования технология производства тетрахлорметана и тетрахлорэтилена. В работе приведено описание основных методов получения тетрахлорметана и тетрахлорэтилена, химизма и физико-химических основ производства, приведено подробное описание технологической схемы производства тетрахлорэтана и тетрахлорэтилена, выполнен расчет материального и теплового балансов. СОДЕРЖАНИЕ Введение 1.Аналитический обзор 1.1 Получение тетрахлорметана 1.2 Получение тетрахлорэтилена 1.3 Переработка хлорорганических отходов. Производство перхлоруглеводородов 1.4 Хлорирование метана 1.5 Условия процесса и типы реакторов 1.6 Рекомендуемые материалы для оборудования процессов получения хлорорганических соединний 1.7 Современный патентный обзор 2. Технологическая часть 2.1 Химизм процесса 2.1.1 Методы замещения (субститутивное галогенирование) 2.1.2 Методы присоединения (аддитивное галогенирование), галогенирующие агенты 2.1.3 Метод расщепления галогенпроизводных 2.1.4 Термическое хлорирование 2.1.5 Фотохимическое хлорирование 2.1.6 Хлорирование в присутствии свободных радикалов 2.1.7 Ионно-каталитическое хлорирование 2.1.8 Газофазное хлорирование 2.1.9 Жидкофазное хлорирование 2.2 Описание технологической схемы 2.3 Технико-технологические расчеты 2.3.1 Расчет материального баланса 2.3.2 Расчет закалочной колонны КЛ1 2.3.3 Тепловой расчет хлоратора Заключение Список использованной литературы ВВЕДЕНИЕ Производство органических веществ зародилось давно, но первоначально оно базировалось на переработке растительного или животного сырья – выделение ценных веществ (сахар, масла) или их расщепление (мыло, спирт и др.). Органический синтез, т. е. получение более сложных веществ из сравнительно простых, зародился в середине XIX века на основе побочных продуктов коксования каменного угля, содержавших ароматические соединения. Затем, уже в XX веке как источники органического сырья все большую роль стали играть нефть и природный газ, добыча, транспорт и переработка которых более экономичны, чем для каменного угля. На этих трех видах ископаемого сырья главным образом и базируется промышленность органического синтеза /1/. Промышленный хлорорганический синтез, развивающийся значительными темпами, позволяет получать широкий ассортимент хлорсодержащих органических продуктов, которые находят применение во всех отраслях народного хозяйства. Среди хлорорганических продуктов большое значение имеют тетрахлорметан (четыреххлористый углерод) и тетрахлорэтилен (перхлорэтилен). Тетрахлорметан является промежуточным продуктом при получении хладона-11 и хладона-12, вспенивателей в производстве пластмасс; используется для извлечения металлов из пирита, протравливания семян и других целей. перхлорэтилен применяется в текстильной промышленности, для обезжиривания металлов, химической очистки одежды, в производстве хладона-113. Поэтому тема данной курсовой работы «Производство тетрахлорметана и тетрахлорэтилена мощностью 40000 т/год» является весьма актуальной. 1. Аналитический обзор 1.1 Получение тетрахлорметана Наиболее старым методом получения ССl4 является «сероуглеродный», в основе которого лежит следующая последовательность реакций /1, 2/:
Сероуглерод образуется при взаимодействии серы (900°С) с кипящим слоем углерода или с метаном (600°С) в присутствии SiО2 и Al2O3 в качестве катализаторов с выходом до 95%. Хлорирование сероуглерода хлором ведут при 60°С в присутствии катализатора сурьмы, а хлорирование монохлоридом серы – на железных опилках. Высокая селективность процесса и чистота целевого продукта, отсутствие затрат на ректификацию для выделения ССl4 выгодно отличают этот метод от других методов получения четыреххлористого углерода. Однако из-за многостадийности, больших энергетических затрат, а также повышенной пожаро- и взрывоопасности и тяжелых санитарно-гигиенических условий труда в настоящее время метод не представляет промышленного интереса.
но промышленной ценности он не представляет. Исчерпывающее прямое хлорирование метана в одну стадию /1/ Принципиально возможен синтез CCl4 из фосгена /2/:
на практике осложняется, что связано с взрывоопасностью смесей метан – хлор, взятых в стехиометрическом соотношении, а также с необходимостью отвода большого количества тепла. При температуре 400°С, мольном отношении С12:СН4, равном 1:2, и рециклизации низкохлорированных производных метана СС14 является одним из основных продуктов процесса. Возможно получение ССl4 хлорированием метана в кипящем слое катализатора. Имеются сведения о получении СС14 окислительным хлорированием метана при 375-455°С под давлением с использованием расплава катализатора СuО-СuС12 /2/:
Для уменьшения коррозии внутренняя поверхность реактора и его насадка выполнены из керамики. Четыреххлористый углерод образуется с высоким выходом. Эксплуатационные расходы процесса «Transcat»/3-6/ на 1 т СС14: метан – 0,14 т; хлороводород – 0,95 т; электроэнергия – 260 кВт×ч; топливо – 280 ГДж; водяной пар – 2,6 т; охлаждающая вода – 242 м. СС14 можно получить окислительным хлорированием хлорпроизводных пропана смесью хлора и кислородсодержащего газа при 250-450°С в присутствии катализатора цеолита в Са2+-форме с окклюдированным хлорид-ионом. Четыреххлористый углерод получают совместно с тетрахлорэтиленом термическим хлорированием пропан-пропиленовой фракции хлорпропанов, а также хлорорганических отходов при 400-550°С /5, 6/:
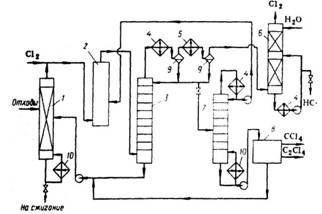
Полученный по такому способу СС14 отличается высокой чистотой. Расход сырья на 1 т СС14: хлор – 1,56 т; С3-фракция – 0,102 т. Побочно образуется 0,585 т НС1, из которого получают товарную хлороводородную (соляную) кислоту. Принципиальная схема получения СС14 при высоких температурах и давлениях приведена на рис. 1.1. Принципиальная схема получения СС14 при высоких температурах и давлениях
Рис. 1.1. 1, 6, 7, 8 - ректификационные колонны; 2 - испаритель; 3, 9 -осушители; 4- подогреватель; 5 - реактор; 10 - смеситель; 11 -холодильник; 12 - кипятильник. I - хлорированные углеводороды; II - хлор; III - сажа, смола; IV - хлороводород; V-CC14. При усовершенствовании процесса хлоролиза для получения СС14 рекомендован ввод сырья в реактор через сопло с трубкой, которая всасывает реакционную смесь. При этом достигается высокая производительность при относительно небольшом избытке хлора (10-50%). Перед входом в реактор хлоролиза 5 (рис. 1.1) хлорсодержащие соединения делят предварительно на легкие и тяжелые фракции в колонне ректификации 1. Легкие фракции сушат (3) над алюмогелем или силикагелем, а тяжелые отделяют от сажи и смол в пленочном испарителе 2. После осветления указанные фракции объединяют, подогревают (4) и подают в смеситель 10, где смешивают с высушенным в аппарате 9 хлором. Хлоролиз при 550-600°С и 18-20 МПа приводит к образованию, в основном, ССl4. С верха колонны 7 отводят НСl, из средней части колонны 7 отводят смесь CCl4 и НС1 и направляют на рециркуляцию, как и кубовый остаток колонны 5. Товарный ССl4 выделяют сверху колонны 5. Удельный расход сырья (хлорпроизводные С3) и энергоресурсов на 1 т целевого продукта (ССl4:С2Сl4 = 1:1): хлоруглеводороды - 0,6 т; хлор - 1,8 т; электроэнергия 150 кВт×ч; водяной пар – 17 ГДж. Установка производит 0,5 т хлороводородной кислоты на 1 т четыреххлористого углерода. Для получения смеси хлорметанов большой интерес представляет процесс окислительного хлорирования метана, осуществляемый в «кипящем» или неподвижном слое катализатора /6/. Реакцию проводят при 380-450°С; при более высокой температуре происходят побочные реакции глубокого окисления и, кроме того, усиливается коррозия оборудования. Оптимальная температура процесса окислительного хлорирования метана равна 360-380°С при времени контакта 5-15 с. Суммарный выход хлорметанов в расчете на прореагировавший метан при температуре 380°С, времени контакта 5 с и мольном соотношении СН4:НС1:О2 = 1:1:1 составляет 62-85%. а выход продуктов глубокого окисления - от 15 до 5%. Поскольку окислительное хлорирование метана сопровождается сильноэкзотермичной побочной реакцией глубокого окисления, особую трудность при технологическом оформлении составляет эффективный теплосъем. При работе в неподвижном слое катализатора возникают труднорегулируемые «горячие» точки, для устранения которых рекомендуется помещать катализатор в порядке повышения содержания активной массы по ходу движения реакционного потока. К недостаткам «кипящего» слоя следует отнести большой унос активной массы, слипание частиц катализатора, повышенный выход продуктов глубокого окисления хлорметанов. При проведении процесса в расплаве солей конверсия метана составляет лишь 15—20%, а в реакционной смеси преобладает метилхлорид. Процесс отличается большой сложностью, в связи с чем, по-видимому, никогда не будет реализован в промышленности. Технико-экономическое сравнение методов получения хлорметанов показывает, что перспективными схемами их производства являются следующие /7/: 1) из метанола и хлора через стадию получения метилхлорида; 2) комбинация прямого и окислительного хлорирования метана. Мощность технологической линии составляет до 80 тыс. т хлорметанов в год. Единичная мощность агрегатов: прямого хлорирования – 12-14 тыс. т; окислительного хлорирования – 5-15 тыс. т; получения метилхлорида – 10-20 тыс. т. Удельный расход сырья по «метанольному» способу: метанола – 0,383 т/т; хлора – 0,847 т/т (СН2С12 - 11,8%; СНС13 - 58,8%; СН4 - 28,4%); по метановому способу («сбалансированная» по хлору схема): метана – 1,17 т/т; хлора – 0,89 т/т, что более чем вдвое меньше по сравнению с прямым хлорированием метана. Расход электроэнергии 0,113 т×кВт×ч и 0,280 т×кВт×ч соответственно. Четыреххлористый углерод наиболее крупнотоннажный продукт из хлорпроизводных метана. Мощности по четыреххлористому углероду в 1981 г. составили в Западной Европе, США и Японии соответственно 250, 380 и 70 тыс. т. Производство в США в 1987 г. было на уровне 305,9 тыс. т, а в 1988 - 344,7 тыс. т. Потребность в четыреххлористом углероде в 1983 г. составила для Западной Европы 250 тыс. т, для США - 250 тыс. т и для Японии - 75 тыс. т (табл. 1.1). Таблица 1.1. Структура потребления галогенпроизводных в 1983 г.
Как видно из этих данных, основным потребителем CCl4, определяющим темпы развития производства этого продукта, является промышленность фторхлоруглеродов (F-11 и F-12), которые используются в качестве пропеллентов в аэрозольных упаковках и хладоагентов:
Сейчас наблюдается уменьшение спроса на СС14, что объясняется в основном введением строгих ограничений на использование фторхлоруглеродов в аэрозольных упаковках, поскольку показано, что эти соединения, как и сам СС14, разрушают озоновый слой. Используется СС14 также как средство для тушения пожаров, для обезжиривания металлов, получения фумигантов, извлечения металлов из руд. Определенный интерес представляет синтез w-аминокарбоновых кислот на основе реакции теломеризации:
Процесс проводят при 100°С под давлением в присутствии химических инициаторов; w-аминоэнантовая кислота при поликонденсации образует полиамидную смолу, из которой получают волокно «энант», превосходящее по многим эксплуатационным показателям капроновую нить. 1.2 Получение тетрахлорэтилена Тетрахлорэтилен образуется при высокотемпературном хлорировании дихлорэтана или хлорорганических отходов С3:
Оксихлорирование полихлоридов С2-С3 также приводит к получению и тетрахлорэтиленов:
Современное производство хлорорганических растворителей, таких как тетрахлорэтилен, базируется на этилене, пропан-пропиленовой фракции и, в меньшей степени, этане. Методы, основанные на использовании ацетилена, в значительной мере устарели, однако до настоящего времени они осуществляются в промышленности. Совмещение процессов гидро- и дегидрохлорирования позволяет создать сбалансированную по хлороводороду технологическую схему, поэтому при наличии дешевого ацетилена данный способ может конкурировать с другими. Существенную роль в структуре сырьевой базы играют хлорорганические отходы производства винилхлорида, дихлорэтана, аллилхлорида, эпихлоргидрина и ряда других хлорорганических производств. В целом процесс получения тетрахлорэтилена включает стадии высокотемпературного хлорирования (хлоролиз), дегидрохлорирования соответствующих хлорэтанов. Поскольку на каждой стадии образуется хлороводород, для создания сбалансированной по НС1 схемы последний целесообразно комбинировать со стадией гидрохлорирования или оксихлорирования. Высокотемпературному хлорированию обычно подвергаются хлорорганические отходы C1-С4. Процесс протекает при 500-650°С в полом реакторе или в реакторе с псевдоожиженным слоем катализатора. Перхлорэтилен получают также одновременно с четыреххлористым углеродом хлоролизом хлорорганических отходов С3, например отходов производства аллилхлорида. Процесс хлоролиза осуществляется при 500°С в избытке хлора. Основными недостатками процесса хлоролиза являются образование побочных хлористого водорода, гексахлорбензола и сажи. При хлоролизе протекает реакция:
которая позволяет регулировать отношение между четыреххлористым углеродом и тетрахлорэтиленом. Процессы получения тетрахлорэтилена на базе этилена осуществляются двумя способами. Первый способ - двухстадийный, на первой стадии которого прямым хлорированием этилена при температуре 136°С получают смесь тетра- и пентахлорэтанов, на второй - их подвергают высокотемпературному пиролизу с образованием тетрахлорэтилена. Расход тепловой энергии при термическом дегидрохлорировании сопоставим с расходом тепловой энергии дегидрохлорирования по известковому методу. Стадия дегидрохлорирования хлорэтанов осуществляется в присутствии инициатора или катализатора. Ряд авторов, с целью создания сбалансированной по хлороводороду схемы, предлагают проводить процесс дегидрохлорирования в присутствии кислорода, условно называя этот процесс «окислительным дегидрированием» /7/:
Реакция протекает в присутствии традиционного катализатора СuС12×КС1/носитель или МnО2 Предлагаемый способ дегидрохлорирования является весьма перспективным. Недостатком способа получения тетрахлорэтилена на основе этилена является потеря хлора в виде неутилизируемого хлороводорода. Поэтому более целесообразно проводить двухстадийный процесс следующим образом: на первой стадии методом окислительного хлорирования этилена при 200-230°С в кипящем или стационарном слое катализатора получать 1,2-дихлорэтан, а затем на второй стадии подвергнуть его высокотемпературному хлорированию. Таким образом удается утилизировать часть хлороводорода. Большой интерес представляет другой способ получения тетрахлорэтилена - одностадийное окислительное хлорирование углеводородов С2. Для производства тетрахлорэтилена часто применяют не сам этилен, а его хлорпроизводные, например 1,2-дихлорэтан. По разработке фирмы «PPG, Industries Inc.» /7/ процесс окислительного хлорирования 1,2-дихлорэтана проводят в трубчатом реакторе с псевдоожиженным слоем катализатора. Температура процесса поддерживается за счет кипящей в межтрубном пространстве жидкости. Тепло реакции используется для получения пара, необходимого для самого процесса. В настоящее время ведутся интенсивные работы по повышению селективности данного процесса. Введение хлоридов редкоземельных элементов позволяет снизить выход продуктов глубокого окисления в 3 раза. Для повышения селективности процесса окислительного хлорирования 1,2-дихлорэтана применяют непрерывную подачу в реакционную зону 1,1,2-трихлорэтана. Образованию продуктов глубокого окисления способствуют местные перегревы, для устранения которых в работе процесс проводят в присутствии катализатора, содержащего хлорид меди с добавлением фосфата щелочного металла. В работах снижение выхода продуктов глубокого окисления достигается секционированной подачей кислорода, благодаря чему по мере прохождения кислорода по слою катализатора в реакцию вступают все более хлорированные углеводороды. Выявлению причин образования продуктов глубокого окисления в научно-технической литературе посвящено лишь небольшое число публикаций. Окислительному хлорированию с целью получения четырех-хлористого углерода и тетрахлорэтилена подвергается смесь углеводородов C1-C4, хлоруглеводородов С3 и хлоруглеводородов С4-С6. В отличие от хлоролиза хлоруглеводородов С3, приводящего к образованию эквимольной смеси СС14 и C2HCl3, состав продуктов окислительного хлорирования существенно зависит от используемого катализатора. Перечисленные способы окислительного хлорирования основаны на использовании в качестве хлорирующего агента смеси HCl-газа и кислорода. Ввиду неполной конверсии НС1, а также его образования при окислении и дегидрохлорировании хлоруглеводородов этот газ содержится в конечных продуктах, что создает проблему утилизации абгазного НС1 или загрязненной хлоруглеводородами HCl-кислоты. Вовлечение этой кислоты в процесс окислительного хлорирования несомненно представляет практический интерес, поскольку до настоящего времени она не находит сбыта и загрязняет окружающую среду. В процессе окислительного хлорирования с получением три- и тетрахлорэтилена могут быть использованы хлоруглеводороды C1-С3. При использовании 1,2-дихлорэтана катализатором процесса является цеолит с содержанием 4% (мас.) Сu2+ и 2,5% К+. Процесс протекает при температуре 400 °С, мольном отношении реагентов C2H4Cl2:O2:HCl:H2O = = 1:1,4:1,2:5,6 и времени контакта 10-25 с. Процесс характеризуется ровным температурным профилем по длине реактора и достаточно высокой селективностью. Оксихлорированне полихлоридов С3 с образованием четыреххлористого углерода и тетрахлорэтилена сопровождается процессами глубокого окисления, а распределение продуктов, а именно хлорметанов и хлорэтиленов, зависит от используемой каталитической системы. Перераспределение между хлорметанами и хлорэтиленами, очевидно, связано с возможностью превращения хлорпроизводных C1 в хлорпроизводные С2 или их различной реакционной способностью в реакции окисления. Изучался процесс окисления в железной, цинковой и медной трубках хлорпроизводных углеводородов, реакционная способность которых в реакции окисления оценивалась по количеству образовавшегося фосгена; установлено, что наибольшей способностью превращаться в фосген обладает четыреххлористый углерод: СС14>СНС13>С2НС13>С2С14. Таким образом, основным недостатком процессов окислительного хлорирования хлорпроизводных углеводородов является образование продуктов окисления и высокая экзотермичность процесса, что делает этот процесс труднорегулируемым. Наибольшее распространение получили трубчатые реакторы со съемом тепла циркулирующим в межтрубном пространстве теплоносителем. Поэтому для обеспечения хорошей теплопроводности процессов и снижения износа катализатора выбор носителя имеет существенное значение. Для увеличения срока службы катализатора и поддержания его первоначальной активности предлагаются различные меры, например периодическая замена части загрузки катализатора, размещение по высоте реактора катализатора с различным содержанием активной массы, постепенное повышение температуры реакции; регулирование суммарного теплового эффекта реакции путем изменения состава и соотношения в подаче сырья, состоящего из смеси 1,2-дихлорэтана и других хлоруглеводородов С2 с различной степенью замещения хлором. Добавление полихлорэтанов к дихлорэтану позволяет вести процесс без избыточного выделения тепла, что устраняет местные перегревы и увеличивает срок службы катализатора. Однако из-за высокой экзотермичности процесса окислительного хлорирования с участием медьсодержащего солевого трегерного катализатора возникают трудности, связанные со съемом тепла реакции, недостаточностью контакта с сырьем, что отрицательно сказывается на полноте хлорирования и на селективности процесса. Для улучшения теплопередачи, увеличения выхода и повышения селективности, сохранения активности катализатора фирмы «Du Pont» и «Lummus» разработали процессы оксихлорирования хлорпроизводных углеводородов Сг с при менением катализатора в виде расплава. В состав катализатора фирмы «Lummus» входят хлориды и оксиды Mn, Fe, Си, Со, Сг, а также хлориды К и Li. Указанный катализатор позволяет снизить температуру начала плавления до 260 °С. Процесс протекает при температуре 359-650°С, давлении 0,1-2 МПа и времени контакта 1-60 с. Описан процесс, в котором наряду с тетрахлорэтиленом образуется четыреххлористый углерод. Исходная реакционная смесь состоит из четыреххлористого углерода, хлоруглеводорода, хлороводорода и кислорода. Катализаторы состоят из хлоридов меди, щелочного и щелочноземельного металла, а также хлорида Fe, Zn, Mn, Cr, Ni, Pd и хлорида редкоземельного металла. Применение ка тализатора в виде расплава связано с повышенными энергозатратами и сильной коррозией оборудования. Наиболее перспективным способом получения три- и тетра-хлорэтиленов в настоящее время является окислительное хлорирование хлорорганических отходов, позволяющее улучшить баланс процессов хлорирования по хлористому водороду. Технологическая схема (рис. 1.2) процесса включает окислительное хлорирование полихлоридов С3, закалку реакционных газов, конденсацию и стабилизацию продуктов реакции /7/. Окислительное хлорирование полихлоридов С3 осуществляется в трубчатом реакторе со стационарным слоем нанесенного медьсодержащего катализатора. Тепло реакции снимается циркулирующим в межтрубном пространстве теплоносителем, в качестве которого используется дифенильная смесь. Полихлориды С3, представляющие собой отходы производства глицерина и пропиленоксида, и НС1 (кислота) после предварительного нагрева в испарителях 2 и 1 соответственно перед поступлением в реактор-оксихлоратор 3 смешиваются. Соотношение исходных реагентов определяет состав конечных продуктов. Оксихлорирование осуществляется при температуре 400°С и времени контакта 5-8 с. Контактный газ после предварительного охлаждения в закалочном сопле 4 до 300°С за счет впрыска HCl-кислоты направляется в низ закалочной колонны 5. В закалочной колонне происходит охлаждение реакционных газов до 100°С, конденсация основной части хлоруглеродов и воды, отгонка хлоруглеводородов в виде азеотропной смеси с водой, а также абсорбция хлороводорода с получением 20%-й HCl-кислоты в кубе колонны. Хлоруглеводороды и HCl-кислота из куба закалочной колонны направляются в разделительный сосуд 7, откуда 20%-я кислота, после смешения ее со свежей кислотой, возвращается в процесс. Часть HCl-кислоты направляется для орошения в закалочную колонну и в закалочное сопло. Принципиальная схема процесса окислительного хлорирования полихлоридов С3
Рис. 1.2. 1,2 - испарители; 3 - реактор; 4 - закалочное сопло; 5 - закалочная колонна; 6, 7, 9, 16, 20 - разделительные сосуды; 8 - колонна осушки; 10 - 15 -ректификационные колонны; 17, 18, 21, 22 - осушители; 19, 23 - сборные емкости; 24 - конденсаторы-холодильники; 25 - кипятильники. I - НС1; II - воздух; III - полихлориды С3; IV - ССl4; V - NaOH; VI - C2HC13; VII -C2C14; VIII - стабилизатор; IX – ССl4, С2НС13; X - 1,2-дихлорпропан; XI - тяжелая фракция; XII - НС1, СО2; XIII - хлоруглеводороды; XIV - легкая фракция; XV - полихлорпропаны. Реакционные газы с верха закалочной колонны, пройдя последовательно систему холодильников (водного и рассольного) поступают в разделительный сосуд 6. Водный слой направляется на орошение в закалочную колонну, а хлоруглеводороды из обоих разделительных сосудов 6 и 7 направляются в колонну азеотропной осушки 8. Хлоруглеводороды, содержащие небольшое количество воды, хлороводорода, хлора, диоксида углерода, поступают в колонну 8, где нейтрализуются за счет отгонки растворенных кислых газов и подвергаются азеотропной осушке. В сосуде 9 происходит разделение хлоруглеводородов и воды. Вода направляется на очистку сточных вод, а хлоруглеводороды - на орошение колонны осушки 8. С низа колонны азеотропной осушки хлоруглеводороды направляются на ректификацию (колонны 10-15). Кубовая жидкость колонны 10 представляет собой высококипящие хлоруглеводороды, такие как полихлорпропаны и пентахлорэтан, которые возвращаются в процесс оксихлорирования. В колонне 11 происходит отделение хлоруглеводородов с температурой кипения не выше 130°С, т. е. CCl4, C2HCl3, C2Cl4 и непрореагировавший дихлорпропан. С верха колонны 12 уходит смесь четыреххлористого углерода и трихлорэтилена, а с низа - смесь тетрахлорэтилена и дихлорпропана. В колонне 13 с верха отгоняется непрореагировавший дихлорпропан, который возвращается в процесс, а с низа - тетрахлорэтилен-ректификат, который после обработки 10%-м раствором NaOH направляется на расслаивание в разделительный сосуд 16. Продукт, пройдя последовательно осушители 17 и 18, заполненные твердым гидроксидом натрия и хлоридом кальция, направляется в емкость 19, где происходит его стабилизация N-метилморфолином. Для разделения четыреххлористого углерода и трихлорэтилена используются две ректификационные колонны 14 и 15. Четыреххлористый углерод отгоняется с верха колонны 14, а трихлорэтилен - с низа колонны 15. Трихлорэтилен-ректификат также подвергается обработке щелочью (20), сушке (21, 22) и стабилизации триэтиламином (23). Отходящие газы оксихлорирования, содержащие кислород, диоксид углерода, незначительное количество хлороводорода, хлора и легких хлоруглеводородов, возвращаются в процесс. Часть отходящих газов постоянно выводится из системы и направляется в колонну 14, орошаемую захоложенным 1,2-дихлор-пропаном, где происходит абсорбция почти всех легких углеводородов, хлора, хлороводорода и диоксида углерода. Абсорбированные хлоруглеводороды после десорбции хлороводорода, хлора и диоксида углерода возвращаются в процесс оксихлорирования. Удельный расход сырья и энергоресурсов при получении перхлоруглеродов окислительным хлорированием отходов хлорорганических производств: хлорорганические отходы - 0,73 т; НС1 - 0,35 т; кислород - 0,33 т; катализатор - 0,3 кг; энергия - 0,40 т. у. т. Тетрахлорэтилен - универсальный негорючий растворитель, обладающий высокой растворяющей способностью по отношению к жирам, маслам, парафинам, различным смазкам, полимерам, что позволяет применять его для холодного и парового обезжиривания металлов, обработки текстиля, чистки одежды, сольвентной экстракции, в качестве полупродуктов в органическом синтезе, в производстве фреонов, клеев, аэрозольных упаковок, покрытий. Важным преимуществом тетрахлорэтилена является возможность его регенерации. Мощности по тетрахлорэтилену в 1985 г. составляли в США /7/ - 380 тыс. т, в Европе - 450 тыс. т. Общая мощность для США и стран Западной Европы 1 млн. т/год. Производство в 1985 г. было на уровне 220 тыс. т в США, 100 тыс. т в ФРГ и 600-700 тыс. т в США и Западной Европе. Производство тетрахлорэтилена в США в 1988 г. составило 224,8 тыс. т, а мощности установок на начало 1989 г. были на уровне 326,9 тыс. т. Спрос в США в 1988 г., в 1989 и 1993 гг. (оценка) находится на уровне 224,7 тыс. т. 1.3 Переработка хлорорганических отходов. Производство перхлоруглеводородов Создание безотходных технологий производства хлорорганических продуктов - одно из главных требований, предъявляемых при разработке современных процессов. Проблема уменьшения отходов, как правило, решается в двух направлениях: за счет повышения селективности процесса, т. е. применения соответствующих каталитических систем и оптимальных условий проведения процесса; с другой стороны за счет рациональной переработки образующихся отходов. Основные используемые методы переработки хлорорганических отходов - огневое обезвреживание, хлорирование при повышенных температурах и хлоролиз (хлорирование при повышенной температуре и давлении). Самый распространенный метод - огневое обезвреживание, сущность которого заключается в высокотемпературном (1100-1800°С) окислении за счет теплоты сгорания отходов и тепла, выделяющегося при сгорании дополнительного количества топлива (в случае малой теплотворной способности отходов). В процессе работы отходы практически полностью превращаются в НС1, С12, СО2, Н2О. Достоинство метода - относительная простота, незначительные капитальные вложения. В установках можно обезвреживать практически все виды отходов. Недостатки метода - полная потеря углеродной части отходов (превращение в СО2); трудность использования НС1, выделяемого в виде загрязненной соляной кислоты. Ввиду этого часто проводят просто нейтрализацию кислоты; в этом случае теряется и хлор, содержащийся в отходах, а также образуется большое количество дополнительных солевых стоков; в случае нарушения режима возможно неполное сгорание отходов с образованием высокотоксичных соединений. Исчерпывающее хлорирование как самостоятельный процесс или в сочетании с окислительным хлорированием является по сравнению с процессом сжигания более эффективным методом переработки, поскольку отходы превращаются в ценные хлорорганические продукты — четыреххлористый углерод, три- и тетрахлорэтены. Исчерпывающее хло рирование (или так называемый хлоролиз) алифатических углеводородов и их хлорпроизводных, осуществляемый при температуре 450-600°С и давлении 0,1-0,3 МПа, приводит к образованию перхлоруглеводородов: четыреххлористого углерода, тетрахлорэтена, гексахлорэтана, гексахлорбутадиена, гексахлорциклопентадиена и гексахлорбензола. Ароматические и жирноароматические соединения в этом случае превращаются в основном в гексахлорбензол, который далее разлагается в очень жестких условиях. В зависимости от вида отходов степень использования отходов составляет 90 %. В процессе хлоролиза одновременно протекает множество последовательно-параллельных реакций хлорирования, дехлорирования, дегидрохлорирования, разрыва углеродных связей, диспропорционирования. В условиях промышленного хлоролиза, осуществляемого при температуре 600°С в объеме или в псевдоожиженном слое (например, песка), в тетрахлорэтен и четыреххлористый углерод могут быть переработаны в основном хлорпроизводные, содержащие до четырех атомов углерода в молекуле. Суммарно процесс хлоролиза для хлоруглеводородов предельного ряда описывается следующими уравнениями:
К недостаткам этого процесса можно отнести прежде всего ограниченность ассортимента перерабатываемых отходов, в основном C1-С4. При переходе к отходам, содержащим 4 и более атомов углерода, резко возрастает количество вторичных отходов, которые необходимо подвергать термическому обезвреживанию или захоронению. Переработка полихлоридов С6 этим методом практически невозможна. Осуществление хлоролиза при высоких давлениях (до 20 МПа) и температурах (600 °С) позволяет перерабатывать в четыреххлористый углерод любые углеводороды и хлоруглеводороды, в том числе и ароматические. В процессе хлоролиза, разработанном фирмой "Hochst", образующийся хлорид водорода, выделяемый ректификацией под высоким давлением, имеет высокую степень чистоты и может быть направлен в процессы гидрохлорирования и оксихлорирования. Основные трудности при реализации и эксплуатации этого процесса связаны с довольно сложным аппаратурным оформлением технологической схемы и применением дорогостоящих конструкционных материалов. Все рассмотренные выше процессы переработки отходов связаны с образованием большого количества хлорида водорода, который можно использовать для процессов гидрохлорирования, оксихлорирования, а также для получения соляной кислоты. При переходе на метод окислительного хлорирования отходов сокращается потребление хлора и соответственно практически исключается образование хлорида водорода. Наиболее интересна разработка сбалансированного процесса переработки отходов, включающего стадии прямого и окислительного хлорирования. На рис. 1.3 представлены варианты раздельного и совмещенного процессов прямого и окислительного хлорирования. Процесс прямого хлорирования ведут в объеме или псевдоожиженном слое кварцевого песка при температуре 500-600°С. Процесс оксихлорирования может осуществляться в псевдоожиженном или стационарном слое катализатора на основе хлорида меди при температуре 350-450°С. К достоинствам совмещенного процесса относится сокращение в 2-3 раза расхода хлора и отсутствие побочного НС1; к недостаткам - сгорание части отходов до оксидов углерода и более сложное аппаратурное оформление по сравнению с процессом прямого хлорирования. Предполагаемые расходные коэффициенты на 1 т отходов: хлора, т - 0,6-0,8 (в случае переработки отходов производства винилхлорида); электроэнергия, кДж - 6,47×105; пар, кДж - 2,1×106 - 8,37×106. В последнее время привлекают внимание технологов такие эффективные методы переработки отходов, как плазмохимический и электрокрекинг. Эти методы имеют степень превращения углеродного сырья в этилен и ацетилен и хлора в НС1, близкую к 100 %. В плазмохимическом методе в качестве теплоносителя используется водород или его смесь с другими газами, нагретыми в электрической дуге до температуры, при которой молекулы и атомы ионизируются. В результате получается низкотемпературная плазма с температурой 3500-5000 К, которая смешивается с отходами. В процессе реакции происходит превращение углерода в непредельные соединения (этилен, ацетилен), метан, и технический углерод; хлора - в хлорид водорода, кислорода - в оксиды углерода, т. е. полученный газ является сырьем для синтеза хлорорганических продуктов. Варьируя состав сырья и режим пиролиза, можно изменять мольное отношение ацетилена и этилена в широких пределах: 0,5-4. Такой состав газов позволяет создавать технологию производства хлорорганических продуктов, сбалансированную по хлору без использования стадии оксихлорирования, и тем самым исключить образование побочного хлорида водорода и потери углеводорода и водорода. Переработка хлорорганических отходов
Рис. 1.3. а) получение перхлоруглеводородов прямым и окислительным хлорированием; б) получение перхлоруглеводородов совмещением прямого и окислительного хлорирования. При электрокрекинге, т. е. в условиях электрического разряда, создаваемого в жидких диэлектриках, каковыми являются большинство органических, в том числе и хлорорганических соединений, жидкие продукты разлагаются с получением крекинг-газа, содержащего до 30 % ацетилена, 8-10 % этилена и других олефинов, предельные углеводорода и хлорид водорода. Применяя высоковольтные и низковольтные источники питания, в определенных условиях можно добиться высокой стабильности электрической дуги и, следовательно, непрерывного процесса в течение длительного времени. Несомненным преимуществом процесса электрокрекинга в жидкой среде является доступность конструкционных материалов для изготовления основного агрегата, так как высокая температура (тысячи и десятки тысяч градусов) развивается в межэлектродном пространстве, а температура стенки равна температуре окружающей среды вне реактора. Примером утилизации отходов методом электрокрекинга может быть процесс получения винилхлорида из легкой бензиновой фракции, сопровождающийся образованием органических отходов на стадии крекинга и хлорорганических на стадиях производства винилхлорида (из ацетилена и этилена через дихлорэтан). В этом случае может быть создано безотходное производство, полностью сбалансированное по углеродному и хлорному сырью. Главным недостатком плазмохимического метода переработки отходов и электрокрекинга по сравнению с более традиционными методами является высокий расход электроэнергии. Приведенные выше примеры переработки отходов в товарные продукты или исходное углеводородное и хлорное сырье могут входить в состав разрабатываемых сбалансированных схем производств хлорорганических продуктов в самых различных вариантах, в зависимости от конкретных требований и специфики данного процесса. 1.4 Хлорирование метана Первые работы по хлорированию метана в псевдоожиженном слое катализатора относятся к середине шестидесятых годов. Было показано, что в кипящем слое различных катализаторов (активный уголь, пемза, кварцевый песок и т. д.) в интервале температур 250-500°С и стехиометрическом соотношении Сl2:СН4 равном 4, идет преимущественное образование четыреххлористого углерода СС14. В результате изучения влияния температуры, соотношения реагентов и природы катализатора на состав реакционного продукта были выбраны условия (температура 350-360°С, мольное соотношение С12:СН4 = 3,6:1, катализатор - активный уголь), обеспечивающие выход СС14 не менее 90 %. В лаборатории и на опытно-промышленной установке в реакторе диаметрам 400 мм отработан процесс получения ССl4 в псевдоожиженном слое пемзы и кварцевого песка. Проверка в опытно-промышленном реакторе показала, что пемза из-за быстрого обуглероживания поверхности и комкования частиц имеет ограниченный срок службы: уже через 20 часов наблюдается заметное падение активности катализатора. Использование в качестве катализатора кварцевого песка более предпочтительно, так как за период испытаний в течение 1500 часов падения активности не наблюдалось. В результате проведенных работ было показано, что при температуре 360-370°С и соотношении Cl2:CH4 = 3,7±0,1:1 достигается практически полное связывание хлора, а выход ССl4 не менее 70 %. На основании комплекса лабораторных и опытных исследований выполнено математическое моделирование процесса хлорирования метана в псевдоожиженном слое катализатора. Расчет процесса по двухфазной модели и сравнение с экспериментальными данными, полученными в опытном реакторе диаметром 600 мм, показали, что при температуре 360-390 °С и соотношении С12:СН4 = 3,7-3,8 :1 имеет место полное связывание хлора; содержание ССl4 в реакционном продукте составляет не менее 90 % (масс). Помимо проведения реакции исчерпывающего хлорирования метана до ССl4 представляло интерес выявить возможность преимущественного получения метиленхлорида и хлороформа. С этой целью был выполнен большой объем исследований по изучению реакции хлорирования метана и его хлорпроизводных в псевдоожиженном слое силикагеля, активного угля и кварцевого песка. В температурной области 250-450°С были изучены основные кинетические закономерности реакции, получены уравнения скорости хлорирования метана и его хлорпроизводных и определены параметры уравнений. Это позволило оценить реакционную способность метана и хлорметанов. В зависимости от вида катализатора она имеет вид: на кварцевом песке СН3С1 > СН2С17 >СН4>СНС13, на активном угле СН3С12 > СНС13 >СН3С1>СН4. На основании полученных значений констант скоростей хлорирования было показано, что для исчерпывающего хлорирования метана до ССl4 целесообразно в качестве катализатора использовать активный уголь, а для ограниченного хлорирования - песок и силикагель. Следует отметить, что кинетические данные, полученные разными авторами, достаточно противоречивы. Это можно видеть на примере соотношения констант скоростей хлорирования метана и хлорметанов, полученных при хлорировании на песке: k1:k2:k3:k4 - 1,0:2,5:1,4:0,6 и 1,0:2,0:1,0:0,5. С целью уточнения кинетики и механизма реакции хлорирования выполнено исследование этой реакции в проточно-циркуляционной установке. Реакцию хлорирования изучали при температурах 275-400°С в присутствии большой группы контактов, различающихся макроструктурой и химической природой: кварц, перлит, кокс, силикагели и др. Для сравнения были проведены исследования реакции термического хлорирования и фотохлорирования. Выполненные исследования для реакции термического хлорирования подтвердили литературные данные, а для фотохлорирования и каталитического получены одинаковые закономерности: дробный порядок по метану (0,5-0,6) и близкий к первому порядок по хлору (0,8-1,0). Энергия активации в зависимости от природы контакта изменяется от 100 до 117 кДж/моль. Установлено, что реакция хлорирования в присутствии пористых контактов протекает по гетерогенно-гомогенному механизму с генерацией атомарного хлора поверхностью контакта. Хлорирование метана возможно и в присутствии хлоридов металлов, нанесенных на пористый носитель. Как правило, используют хлориды металлов переменной валентности. Использование таких катализаторов снижает энергию активации процесса, повышает его скорость и выход продуктов глубокого хлорирования. Каталитические свойства таких систем связывают с их способностью к генерированию атомарного хлора. Большое внимание было уделено изучению зависимости процесса хлорирования от фактора масштабного перехода, что особо важно для процессов в псевдоожиженном слое. Так, при увеличении диаметра аппарата наблюдалась неудовлетворительная воспроизводимость лабораторных данных по конверсии реагентов и составу хлорметанов, а также по увеличению выхода побочных продуктов и сажеобразования. Сопоставление данных, полученных в реакторах различного диаметра (от 50 до 600 мм), изучение плотной и пузырьковой фазы псевдоожиженного слоя позволило авторам предположить наличие локальных перегревов не в пузырях, а в плотной фазе, так называемых «сгущениях» частиц, и в связи с этим предложить трехфазную модель псевдоожиженного слоя. 1.5 Условия процесса и типы реакторов Несмотря на отсутствие пли слабое ингибирующее действие кислорода, при газофазном хлорировании все же используют хлор, полученный испарением жидкого хлора, так как при рециркуляции непревращенного углеводорода инертные примеси электролитического хлор-газа быстро накапливаются до недопустимого уровня. При хлорировании метана целевыми продуктами обычно являются метиленхлорид, хлороформ, тетрахлорметан или их смеси. При целевом синтезе метиленхлорида мольное отношение метана к хлору берут равным 4:1, возвращая непревращенный метан и хлорметан на реакцию. При целевом получении хлороформа мольное соотношение СН4: Сl2 составляет 0,8: 1, причем непревращенный метан и СН3С1 возвращают на реакцию, получая наряду с хлороформом метиленхлорид и тетрахлорметан. Хлорирование метана ведут как чисто термическим путем при 500-550°С, так и термокаталитическим при 350-400°С. Хлорирование в газовой фазе всегда осуществляют при атмосферном давлении и непрерывно, пропуская смесь реагентов через хлоратор. Важная операция - смешение исходных веществ, обеспечивающее мгновенную гомогенизацию смеси. Для этого служат специальные смесители, например тангенциального типа, в которых происходит интенсивное завихрение и перемешивание смеси. Реакторы для хлорирования в газовой фазе бывают трех основных типов (рис. 1.4). Общими для них являются защита стального корпуса (от действия высоких температур и коррозии) керамической футеровкой, а также автотермичность протекающего в них процесса. Последнее достигается тем, что выделяющееся при реакции тепло расходуется на нагревание смеси до нужной температуры и на потери в окружающую среду. При этом в зависимости от теплового баланса процесса приходится подавать реагенты в хлоратор холодными (при синтезе полихлоридов метана, когда тепловой эффект реакций очень велик) или предварительно подогретыми (при получении аллилхлорида). В первом случае при термическом хлорировании используют хлоратор типа а, в котором холодные реагенты быстро подогреваются разогретой насадкой, играющей роль аккумулятора тепла. При термокаталитическом хлорировании то же самое достигается за счет нагретых частиц псевдоожиженного слоя катализатора или теплоносителя (тип б), причем для сильно-экзотермических синтезов полихлоридов метана регулирование температуры возможно за счет впрыскивания жидкого ССl4. В обоих случаях наблюдается значительное продольное перемешивание смеси, но при получении хлоридов метана это не так существенно, так как все они имеют практическое применение. При подаче в хлоратор подогретых реагентов (синтез аллилхлорида) реакция может начинаться уже в смесителе, и хлоратор выполняют в виде пустотелой трубы со значительным отношением ее высоты к диаметру (тип в). Время контакта при разных процессах хлорирования изменяется в пределах 0,1-2 с. Для производства три- и тетрахлорэтиленов был разработан совмещенный процесс хлорирования и дегидрохлорирования. В нем вместо предварительного синтеза тетра- или пентахлорэтанов совместили в одном реакторе термическое хлорирование 1,2-дихлорэтана и отщепление НС1 от хлорпроизводных:
Реакторы для газофазного хлорирования
Рис. 1.4. а) с насадкой-теплоносителем; б) с псевдоожиженным слоем теплоносителя (катализатора); в) с предварительным подогревом смеси. В зависимости от мольного соотношения хлора и 1,2-дихлорэтана получаются смеси разного состава, в том числе с преобладанием ди-, три- или перхлорэтиленов или с получением их в желаемом соотношении, причем другие продукты хлорирования можно возвращать на реакцию. В результате снизились капитальные затраты, а кроме того, тепло экзотермической реакции хлорирования эффективно используется для компенсации отрицательного теплового эффекта отщепления НС1. Такой совмещенный процесс можно осуществлять в пустотелом реакторе или в аппарате с псевдоожиженным теплоносителем, снимая избыточное тепло рециркуляцией недохлорированных веществ и тетрахлорэтилена или организуя охлаждение кипящим теплоносителем, который в котле-утилизаторе генерирует пар соответствующих параметров (рис. 1.5) /7/. Реакционный узел для совмещенного хлорирования и дегидрохлорирования 1,2-дихлорэтана с получением три- и тетрахлорэтиленов.
Рис. 1.5 1.6 Рекомендуемые материалы для оборудования процессов получения хлорорганических соединений Углеродистую сталь применяют для изготовления сосудов и баллонов, предназначенных для хранения и транспортировки жидкого хлора. До 200°С сухой газообразный хлор не вызывает усиленной коррозии чугунов и углеродистых сталей; не корродируют в сухом хлоре никель, хастеллой С, монель (до 450°С), алюминий и его сплавы (до 120°С). Однако сухой газообразный хлор разрушает титан (с горением), цирконий. При появлении в хлоре влаги более 0,006% коррозионная стойкость металлов резко меняется. Разрушаются углеродистые стали и чугуны, алюминий, серебро. Напротив, в присутствии влаги приобретают коррозионную стойкость титан, серебро с добавками кадмия. В контакте с влажным хлором применяют антихлор, хромистую сталь. Выдерживают действие влажного хлора керамика, стекло, фарфор, диабаз, резина, специальные каучуки. Поливинилхлорид устойчив к действию хлора до 60°С, а при более высокой температуре - углеграфитовые материалы. Под действием сухого хлороводорода углеродистая сталь, серые чугуны, хромистые и хромоникелевые стали, алюминий, медь, никель, свинец, титан не корродируют. В контакте с влажным хлороводородом применяют свинец, тантал, хастеллой Б, углеграфиты. Рекомендуется применение гуммированной аппаратуры (в отсутствие органических примесей), а также футеровка металлической конструкции фарфором, керамикой, эмалью, стеклом. Для работы с концентрированной хлороводородной кислотой при повышенной температуре (до 100°С) рекомендуется антихлор, антегмит, фторопласт, керамика, стекло, фарфор, эмаль; при температурах до 60°С, кроме перечисленных материалов, применяют также хастеллой В, ферросилид, свинец, винипласт. Для температур от 0 до 50°С этот перечень можно дополнить серебром, полиэтиленом и полипропиленом. Для концентрации хлороводородной кислоты до 20% при повышенной температуре применяют антихлор, хастеллой В, керамику, стекло, эмаль, а при температурах от 0 до 50°С, кроме перечисленных материалов, также ферросилид, серебро, монель, никель, хастеллой В, С, Д, свинец, титан, резину, полиолефины. Сухие хлорсодержащие продукты не разрушают металлы, поэтому растворители, плохо растворяющие воду, не корродируют аппаратуру, изготовленную из черных металлов. Однако для получения высококачественных продуктов необходимо использовать легированные металлы. Коррозия начинается в присутствии влаги. Все растворители разрушают полимерные покрытия, за исключением тефлона. Действие хлорпроизводных растворителей выдерживают фаолит, антегмит, которые применяют для защиты химического оборудования, работающего в среде хлорсодержащих продуктов. В контакте с хлоруксусными кислотами применяют керамику, стали, покрытые слоем свинца, стекло, тефлон, серебро, которое становится инертным благодаря появлению слоя хлорида серебра на его поверхности, применяют для изготовления только части оборудования (теплообменники, мешалки, клапаны). Рекомендуется применение тантала и титана. 2. Технологическая часть 2.1 Химизм процесса Галогенирование углеводородов может осуществляться методом замещения (субститутивное) различных атомов или функциональных групп на атомы галогена или присоединением (аддитивное) галогенирующих агентов по ненасыщенным связям органических соединений или по атомам, находящимся в низшем валентном состоянии, а также методом расщепления /1/. 2.1.1 Метод замещения (субститутивное галогенирование) Из реакций замещения наибольшее промышленное значение имеет замещение атомов водорода на галоген, которое может происходить при насыщенном и ненасыщенном атомах углерода и в ароматической системе:
Замещение одного атома галогена на другой применяется при синтезе фтор-, бром- и иодпроизводных из более доступных хлорорганических производных:
Замещение функциональной группы, например, в спиртах, кислотах:
2.1.2 Метод присоединения (аддитивное галогенирование) галогенирующих агентов Галогены способны присоединяться по двойной и тройной связям алифатических и ароматических углеводородов:
Галогеноводороды присоединяются по двойной и тройной связям (гидрогалогенирование):
олефины также вступают в реакцию хлоргидринирования
Особым случаем присоединения хлора является получение фосгена из оксида углерода и хлора, т. е. хлор присоединяется к атому углерода, находящемуся в низшей валентности:
2.1.3 Метод расщепления галогенпроизводных К этому методу относятся следующие реакции: дехлорирование:
дегидрохлорирование:
расщепление связи С-С под влиянием хлора (хлоролиз):
и высокой температуры (пиролиз):
Все процессы галогенирования по механизму делятся на две группы: радикально-цепные и ионно-каталитические. Парафиновые углеводороды независимо от молекулярной массы хлорируются путем последовательного замещения атомов водорода на хлор. Низшие олефиновые углеводороды хлорируются радикально-цепным путем преимущественно в газовой фазе. При этом конкурируют две реакции: присоединение хлора по двойной связи и замещение атомов водорода:
С увеличением длины углеводородной цепи и повышением температуры роль реакций присоединения уменьшается. Заместительное хлорирование с повышением температуры предпочтительно протекает в наиболее реакционноспособное аллильное положение. Ароматические углеводороды хлорируются радикально-цепными путями даже в отсутствие катализаторов ионных реакций FeCl3, A1C13, а также соответствующих металлов, что ограничивает выбор материала аппаратуры. При этом конкурируют три вида реакций: замещение в боковую цепь, замещение в кольцо и присоединение по С-С связи кольца. Для алкилароматических углеводородов замещение предпочтительно идет в а-положение с последовательным замещением атомов водорода. При пониженных температурах наблюдается присоединение хлора по С-С связи кольца, а при повышенных идет замещение в кольцо. Все рассматриваемые процессы относятся к неразветвленным цепным реакциям, протекающим через промежуточное образование радикалов и свободных атомов. В соответствии с применяемым способом инициирования реакции существует термическое, фотохимическое, инициированное и каталитическое хлорирование. Первым актом зарождения цепи является гемолитическая диссоциация молекулы хлора на атомы. 2.1.4 Термическое хлорирование Осуществляется в газовой фазе под действием тепла. Для этого требуется нагревание до 250°С; при такой температуре становится заметной диссоциация молекул хлора на атомы с участием стенки или насадки:
При сравнительно низких температурах образование свободных атомов происходит в основном за счет взаимодействия хлора с углеводородом:
Чем менее реакционноспособны углеводороды, тем выше должна быть температура, так как образование свободных органических радикалов связано с разрывом связи С-Н в молекуле углеводорода. Например, температура хлорирования бутана составляет около 250°С, а для термического хлорирования метана требуется 400°С. Энергия активации термического хлорирования равна 125 кДж/моль. Термическое хлорирование при высоких температурах может сопровождаться побочными реакциями, деструкцией молекул, дегидрохлорированием и циклизацией. 2.1.5 Фотохимическое хлорирование При этом способе реакция инициируется светом, действие которого наиболее эффективно в коротковолновой части спектра. В этом случае молекулы хлора диссоциируют под влиянием фотонов или квантов энергии /6/:
в качестве источника которых применяются ртутные лампы, излучающие свет длиной волны 1650-5500 А. Если реакционные устройства сделаны из плавленого кварца, можно использовать лучи с длиной волны 1650 А, если же реактор выполнен из стекла пирекс или из обычного стекла, можно использовать лишь лучи с длинами волны более, 3000-3500 А. Для многих реакций фотохимического хлорирования достаточно уже видимого света с длиной волны 4000-5000 А, для чего применяются обычные мощные лампы. Эффективность действия излучения характеризуется квантовым выходом, т. е. числом прореагировавших молекул на один квант поглощенной энергии. Цепная реакция фотохимического хлорирования протекает с большой скоростью при невысоких температурах в жидкой или паровой фазе, а направление реакции часто бывает иным, чем при термическом хлорировании. Энергия активации при фотохимическом хлорировании равна 42 кДж/моль, т. е. примерно в 2,5-3 раза ниже, чем при термическом хлорировании. Реакция фотохимического хлорирования ингибируется (замедляется) некоторыми примесями, которые связывают атомы хлора и обрывают цепь. К таким ингибиторам относится, например, кислород, который с атомами хлора образует оксид хлора:
Однако кислород тормозит реакцию лишь при низких температурах, а при 350-400°С он уже не оказывает заметного действия, что связано с переходом к другому механизму /6/. 2.1.6 Хлорирование в присутствии свободных радикалов Инициаторами жидкофазного хлорирования являются органические пероксиды и азосоеднинения, вызывающие образование атомов хлора при своем распаде на радикалы. Такими инициаторами являются бензоилпероксид и азодиизобутиронитрил:
Образовавшиеся свободные радикалы взаимодействуют с молекулой хлора с образованием атомарного хлора:
В присутствии инициатора скорость хлорирования определяется стадией распада инициатора: при использовании бензоилпероксида скорость оказывается достаточной при 100-120°С, а в случае азодиизобутиронитрила при 70-100°С; энергия активации реакции хлорирования с инициатором ~84 кДж/моль. Заместительное хлорирование проводят также ив присутствии катализаторов, образующих с хлором активные соединения или комплексы, служащие передатчиками атомов С1. Для этой цели применяются хлориды металлов, имеющих переменную валентность. По-видимому, в этом случае возможны реакции передачи атомов хлора
и образования радикалов:
Обрыв цепи при хлорировании в газовой фазе происходит на стенке реактора или насадке
2.1.7 Ионно-каталитическое хлорирование Присоединение хлора по двойной и тройной связям, хлоргидринирование (присоединение НС1О) и гидрохлорирование (присоединение НС1) олефинов, а также замещение хлором водородов ароматического кольца относятся к ионно-каталитическому галогенированию. Присоединение хлора, а также галогеноводородов к ненасыщенным углеводородам идет достаточно легко, ускоряют эти реакции апротонные катализаторы FeCl3, AICl3 и др. Механизм реакций является электрофильным, идет через образование промежуточных p- и s-комплексов:
Роль FeCl3 сводится не только к ускорению стадии перехода p- в s-комплекс, но образованием комплекса С1 ® Cl: FeCl3 (присоединение хлора) и металлхлористоводородной кислоты НА1С14 или HFeCl4 (гидрохлорирование), имеющей активный протон. В процессах присоединения хлора к олефинам побочными продуктами являются полихлориды, что предотвращают применением ингибиторов цепных реакций (кислород). Реакционная активность олефинов зависит от стабильности промежуточного катиона и уменьшается в следующем ряду:
присоединение галогеноводородных кислот к ацетиленовым углеводородам идет последовательно в две стадии:
Поэтому гидрохлорирование ацетилена проводят в присутствии селективных катализаторов, ускоряющих только первую стадию. В основном применяют соли двухвалентной ртути (раньше) и одновалентной меди. Каталитическое действие этих солей объясняют образованием координационных комплексов, в которых ацетилен активируется и взаимодействует с хлоранионами, при этом промежуточно получаются переходные состояния с металл - углеродной связью или металлорганические соединения, быстро разлагаемые кислотой:
Присоединение галогеноводородных кислот к ненасыщенным углеводородам идет согласно правилу Марковникова, т. е. водород идет к наиболее гидрированному углероду, а хлор - к менее гидрированному. В промышленности процесс хлорирования осуществляют как в газовой, так и в жидкой фазе. 2.1.8 Газофазное хлорирование Хлорированием в газовой фазе получают сравнительно небольшое число соединений: хлорпроизводные метана, а также дихлорбутилены/ Газофазное хлорирование проводят при температуре 300-500°С в избытке углеводорода (в целях подавления образования полихлоридов) с рециркуляцией исходного сырья и обязательным предварительным смешением исходных реагентов в специальных смесителях (тангенциального типа), обеспечивающих интенсивное перемешивание смеси. Особенностью реакторов-хлораторов, применяемых для хлорирования в газовой фазе, является наличие внутренней керамической футеровки, а также автотермичность протекающего в них процесса. Последнее достигается тем, что выделяющееся при реакции тепло расходуется на нагревание смеси до требуемой температуры и на потери в окружающую среду. При этом в зависимости от теплового баланса процесса реагенты в хлоратор подают холодными (например, при синтезе полихлоридов метана) или предварительно подогретыми (при получении аллилхлорида). Причем для сильно экзотермических синтезов полихлоридов метана регулирование температуры возможно за счет впрыскивания жидкого четыреххлористого углерода. Технология хлорирования в газовой фазе состоит из следующих стадий: подготовки реагентов (испарение жидкого хлора), предварительного нагрева газообразного хлора, осушки реагентов (адсорбентами или H2SO4), смешения исходных реагентов друг с другом и с рециркулятом, хлорирования, очистки реакционной смеси от хлористого водорода, отделения рециркулирующих веществ и выделения целевого продукта. 2.1.9 Жидкофазное хлорирование Методом радикально-цепного жидкофазного хлорирования получают: полихлорпроизводные метана (1,1,2- и 1,1,1-трихлорэтаны); хлорпарафины (жидкие и твердые); хлорированные полимеры (полиэтиленхлорид, полипропиленхлорид и поливинилхлорид, а также хлоркаучук); хлорпроизводные ароматических углеводородов: (бензилхлорид). Жидкофазное радикально-цепное хлорирование проводится при температурах от 40 до 150°С в присутствии инициаторов или фотохимически. Обычно жидкофазным хлорированием получают моно- и хлорпроизводные, которые нестабильны при повышенных температурах и практически большинство полихлорпроизводных. Процесс в жидкой фазе проводится в аппаратах колонного типа, имеющих внутреннее охлаждение, при барботировании хлора через массу исходных углеводородов или их раствор в растворителях (тетрахлоруглерод, о-дихлорбензол); некоторые полимеры хлорируют в водных и других суспензиях. Подача реагентов осуществляется противотоком. Для повышения селективности процесса применяют секционирование реактора. При хлорировании низкокипящих веществ внутреннее охлаждение отсутствует, так как теплосъем осуществляется за счет испарения этих веществ. Существенное влияние на показатели процесса оказывают соотношение исходных реагентов, температура, концентрация инициатора и интенсивность облучения. При фотохимическом хлорировании температура процесса не выше 40-60°С, применяется отвод тепла реакции циркулирующей водой. При использовании химических инициаторов хлорирование проводится при температуре разложения инициатора. Расход инициатора зависит от молекулярной массы исходного углеводорода, количества вводимого хлора и температуры реакции. Расход инициатора можно уменьшить, вводя его отдельными порциями во времени (при периодическом процессе) или по длине реактора (при непрерывном процессе). Технология жидкофазного радикально-цепного хлорирования состоит из тех же стадий, что и при газофазном хлорировании. 2.2 Описание технологической схемы В процессах хлорирования часто образуются побочные органические продукты, не находящие квалифицированного применения. С целью создания безотходной технологии их предлагали сжигать, регенерируя НС1, но теряя весь углерод в виде СО2. В последнее время разработаны более эффективные процессы, на которых основаны современные методы производства тетрахлорметана и тетрахлорэтилена. Различные хлоралифатические отходы подвергают высокотемпературному хлорированию в газовой фазе. При этом из соединений С2 ранее рассмотренным путем совмещенного хлорирования и отщепления НС1 образуется тетрахлорэтилен. При аналогичной переработке отходов С3 и выше с этими реакциями дополнительно совмещают пиролиз по углерод-углеродной связи; это приводит к получению СС14 и С2С14, например: СН2С1-СНС1-СН2С1 + 5С12 ® СС14 + СС12=СС12 + 5НС1 (2.26) Побочно получаются продукты конденсации (гексахлорбутадиен-1,3, гексахлорбензол), которые в этих условиях не подвергаются хлоролизу, и их уничтожают. Технологическая схема производства тетрахлорметана и тетрахлорэтилена из хлорорганических отходов изображена на рис. 2.1. Смесь отходов подают в испаритель 1, где отделяются тяжелые продукты, направляемые на сжигание. Пары хлорорганических веществ смешивают с избытком хлора (10-15% от стехиометрического) и подают в реактор 2. Последний выполнен в виде пустотелого футерованного аппарата, в котором может находиться псевдоожиженный слой теплоносителя (кварцевый песок). Ввиду очень высокой экзотермичности суммарного процесса съем избыточного тепла осуществляют, вводя в реактор рециркулирующий сырой продукт и поддерживая температуру 500-590°С. Горячая парогазовая смесь из реактора попадает в «закалочную» колонну 3, где за счет орошения жидким конденсатом из водяного холодильника 4 температура снижается до 100-145°С. Тяжелые продукты собирают в кубе и возвращают в испаритель 1. Газовую смесь дополнительно охлаждают в рассольном холодильнике 5, отделяют от конденсата и подают в колонну 6 для адсорбции НС1 водой с получением 30 %-й соляной кислоты и одновременного отделения хлора, который можно возвращать на реакцию или использовать для других целей. Технологическая схема получения тетрахлорметана и тетрахлорэтилена
Рис. 2.1. 1 – испаритель; 2 реактор; 3 – закалочная колонна; 4, 5 – холодильники; 6 – абсорбер; 7 – колонна сухой нейтрализации; 8 – узел ректификации; 9 – сепараторы; 10 – кипятильники. Объединенный конденсат после холодильников 4 и 5 направляют в колонну 7. Там отгоняются растворенные в нем НС1 и С12 вместе с некоторой частью хлорорганических продуктов, которые возвращают в реактор 2 с целью съема избыточного тепла. Жидкие продукты из куба колонны 7 подвергают двухступенчатой ректификации, получая в виде дистиллятов тетрахлорметан и тетрахлорэтилен и возвращая остаток от перегонки в испаритель 1. Различные хлорорганические отходы (в том числе тяжелые остатки от предыдущего способа переработки и циклические хлорорганические продукты, не поддающиеся газофазному расщеплению, а также кислородсодержащие соединения) можно подвергать хлоролизу в жидкой фазе при 550-600°С, 20 МПа и времени контакта 20 мин. При однократном проходе через пустотелый реактор, рассчитанный на работу при высоких давлении и температуре, образуются тетрахлорметан, гексахлорэтан, гексахлорбензол, а из кислородсодержащих соединений - фосген. После дросселирования смеси отделяют тяжелые продукты и возвращают их на реакцию, а из остальной смеси выделяют СС14, фосген, хлор (возвращаемый на реакцию) и безводный хлорид водорода. 2.3 Технико-технологические расчеты 2.3.1 Расчет материального баланса Схема материальных потоков приведена на рис. 2.1. Исходные данные: годовая производительность агрегата по перхлоруглеводородам (отношение ССl4:С2Сl4 = 1:1) 40 000 т; годовой фонд рабочего времени 7250 ч; расход хлоруглевпдородного сырья (в кг на 1 т образующихся перхлоругленодородов CCl4 + C2Cl4): жидкие хлоруглеводороды – 70; жидкие рециркулирующке хлоруглеводороды из емкостей сырого продукта – 655; жидкий 1,2-дихдорэтан из реактора хлорирования этилена 270; объем продуктов отпарки сырца перхлоруглеводородов 20 м3 на 1 т перхлоруглеводородов; степень использования хлора 0,85; селективность но ССl3 в расчете на метан 0,70; состав исходного углеводородного сырья (j, %):
состав хлоруглеводородного сырья:
Последовательность расчета: а) определяют компонентный состав материальных потоков хлоруглево» дородного сырья на вход в хлоратор; б) рассчитывают изменение состава реакционной смеси, расход и состав природного газа и технического этилена; в) составляют материальный баланс хлоратора; г) определяют состав потоков на входе в закалочную колонну, состав газовой фазы в кубовой жидкости на выходе из колонны; д) рассчитывают расход технического этилена па прямое хлорирование, составляют материальные баланс реактора; е) определяют состав сырца перхлоруглеводородов на входе в колонну отпарки, а также передаваемого на стадию выделения товарных продуктов; ж) составляют сводный материальный баланс стадии совместного получения тетрахлорметана в тетрахлорэтилена. Схема потоков стадии получения тетрахлорметана и тетрахлорэтилена приведена на рис. 2.2. Схема потоков получения тетрахлорметана и тетрахлорэтилена
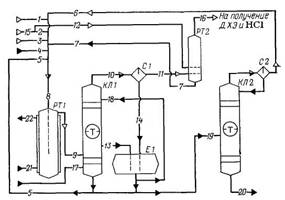
Рис. 2.2. 1 - хлор; 2, 12, 15 - этилен; 3 - природный газ; 4 - жидкие хлоруглеводороды; 5 - рециркулирующие перхлоруглеводороды; 6 - продукты отпарки сырца перхлоруглеводородов; 7 - 1,2-дихлорэтан; 8 - общий поток сырья; 9 - продукты хлорирования; 10, 16 - газовая фаза; 11 - отходящий хлороводород; 13 - кубовая жидкость, 14 - жидкая фаза; 17 - кубовый продукт; 18 - флегмовая жидкость; 19 - сырец перхлоруглеводородов; 20 - смесь целевых продуктов; 21, 22 - вода; РТ1 - реактор газофазного хлорирования; КЛ1 - закалочная колонна; С1, С2 -сепараторы; Е1 - сборник; РТ2 - реактор жидкофазного хлорирования, КЛ2 - колонна отпарки. Часовая производительность агрегата по перхлоруглеводородам: 40000×1000/7250 = 5517,24 кг/ч. в том числе: по CCl4: 5517,24/2 = 2758,62 кг/ч или 2758,62/154 = 17,91 кмоль/ч; по С2Сl4: 2758,62 кг/ч или 2758,62/166 = 16,62 кмоль/ч. Определяем расход хлоруглеводородного сырья на входе в хлоратор: жидкие хлоруглеводороды: 70×5517,27/1000 = 386,21 кг/ч; жидкие рециркулирующие перхлоруглеводороды из емкостей сырого продукта: 655×5,517 = 3613,64 кг/ч; жидкий 1,2-дихлорэтан из реактора хлорирования этилена: 270×5,517 = 1489,59 кг/ч; продукты отпарки сырца перхлоруглеводородов: 20×5,517 = 110,34 м3/ч или 110,34/22,4 = 4,93 кмоль/ч. Состав жидких хлоруглеводородов (поток 4):
Состав жидких рециркулирующих перхлоруглеводородов из емкостей сырого продукта (поток 5):
Состав продуктов отпарки сырца перхлоруглеводородов (поток 6):
Состав жидкого 1,2-дихлорэтана из реактора хлорирования этилена (поток 7)
По реакции С2НСl3 + 3Cl2 ® 2CCl4 + HCl (2.27) расходуется: трихлорэтилена: 0,12 кмоль/ч или 16,23 кг/ч; хлора: 3×0,12 = 0,36 кмоль/ч или 0,36×71 = 25,56 кг/ч; образуется: тетрахлорметана: 2×0,12 = 0,24 кмоль/ч или 0,24×154 = 36,96 кг/ч; хлороводорода: 0,12 кмоль/ч или 0,12×36,5 = 4,38 кг/ч. По реакции СНСl3 + Cl2 ® CCl4 + HCl (2.28) расходуется: трихлорметана: 0,18 кмоль/ч или 21,24 кг/ч; хлора: 0,18 кмоль/ч или 0,18×71 = 12,78 кг/ч; образуется: тетрахлорметана: 0,18 кмоль/ч или 0,18×154 = 27,72 кг/ч; хлороводорода: 0,18 кмоль/ч или 0,18×36,5 = 6,57 кг/ч. По реакции 2С2Н4Сl2 + 8Cl2 ® С2Сl4 + 2CCl4 + 8HCl (2.29) расходуется: 1,2-дихлорэтана: 14,38 кмоль/ч или 1424,26 кг/ч; хлора: (8/2)×14,38 = 57,52 кмоль/ч или 57,52×71 = 4083,92 кг/ч; образуется: тетрахлорэтилена: 14,38/2 = 7,19 кмоль/ч или 7,19×166 = 1193,54 тетрахлорметана: 14,38 кмоль/ч или 14,38×154 = 2214,52 кг/ч; хлороводорода: 57,52 кмоль/ч или 57,52×36,5 = 2099,48 кг/ч. Всего образуется тетрахлорметана: 0,24 + 0,18 + 14,38 = 14,8 кмоль/ч или 2279,2 кг/ч. Необходимо получить дополнительно трихлорметана: 17,91 – 14,8 = 3,11 кмоль/ч или 3,11×166 = 516,26 кг/ч. По уравнению основной реакции: СН4 + 4Cl2 ® CCl4 + 4HCl (2.30) расходуется: метана: 3,11 кмоль/ч или 3,11×16 = 49,76 кг/ч; хлора: 4×3,11 = 12,44 кмоль/ч или 12,44×71 = 883,24 кг/ч; образуется хлороводорода: 12,44 кмоль/ч или 12,44×36,5 = 454,06 кг/ч. При выходе тетрахлорметана в расчете на превращенный метан 0,70 необходимо ввести в процесс метана (без учета метана, содержащегося в техническом этилене): 3,11/0,70 = 4,44 кмоль/ч или 4,44×16 = 71,04 кг/ч. Объемный расход природного газа составит: 4,44/0,94 = 4,72 кмоль/ч, где 0,94 – молярная (объемная) доля метана в природном газе, доли ед. Состав природного газа (поток 3):
Необходимо получить дополнительно тетрахлорэтилена: 16,62 - 7,19 = 9,43 кмоль/ч или 9,43×166 = 1565,38 кг/ч. Тетрахлорэтилен образуется из этилена, а также из этана, содержащегося в природном газе и техническом этилене, поэтому в хлоратор необходимо ввести технического этилена: (9,43 – 0,19)/0,985 = 9,38 кмоль/ч, где 0,985 – молярная доля углеводородов С2 в техническом этилене, доли ед.; 0,19 – количество этана в природном газе, кмоль/ч. Состав технического этилена на входе в хлоратор (поток 2):
Всего в хлоратор поступает метана: 4,44 + 0,0475 = 4,4875 кмоль/ч или 4,4875×16 = 71,8 кг/ч. Остается метана (учитывая его расход на реакцию (2.30): 4,4875 – 3,11 = 1,3775 кмоль/ч или 1,3775×16 = 22,04 кг/ч. По реакции: 6СН4 + 15Сl2 ® C6Cl6 + 24HCl (2.31) реагирует (по экспериментальным данным) 62% оставшегося метана, что составляет: 0,62×1,3775 = 0,85 кмоль/ч или 0,85×16 = 13,6 кг/ч. Расходуется хлора: (15/6)×0,85 = 2,125 кмоль/ч или 2,125×71 = 150,87 кг/ч. Образуется: гексахлорбензола: 0,85/6 = 0,14 кмоль/ч или 0,142×285 = 40,47 кг/ч; хлороводорода: (24/6)×0,85 = 3,4 кмоль/ч или 3,4×36,5 = 124,1 кг/ч. Всего из хлоратора выходит гексахлорбензола: 0,23 + 0,14 = 0,37 кмоль/ч или 0,37×285 = 105,45 кг/ч. По реакции 4СН4 + 11Сl2 ® C4Cl6 + 16HCl (2.32) реагирует 26,5% оставшегося метана, что составляет: 0,265×1,3775 = 0,365 кмоль/ч или 0,365×16 = 5,84 кг/ч; расходуется хлора: (11/4)×0,365 = 1,003 кмоль/ч или 1,003×71 = 71,213 кг/ч; Образуется: гексахлорбутадиена: 0,365/4 = 0,09 кмоль/ч или 0,09×261 = 23,49 кг/ч; хлороводорода: (16/4)×0,365 = 1,46 кмоль/ч или 1,46×36,5 = 53,29 кг/ч. Всего из хлоратора выходит гексахлорбутадиена: 0,65 + 0,09 = 0,74 кмоль/ч или 0,74×261 = 193,14 кг/ч. По реакции 2СН4 + 7Сl2 ® C2Cl6 + 8HCl (2.33) реагирует 11,5% оставшегося метана, что составляет: 0,115×1,3775 = 0,158 кмоль/ч или 0,158×16 = 2,528 кг/ч; расходуется хлора: (7/2)×0,158 = 0,553 кмоль/ч или 0,553×71 = 39,263 кг/ч; Образуется: гексахлорэтана: 0,158/2 = 0,079 кмоль/ч или 0,079×237 = 18,723 кг/ч; хлороводорода: (8/2)×0,158 = 0,632 кмоль/ч или 0,632×36,5 = 23,07 кг/ч. Всего из хлоратора выходит гексахлорэтана: 1,46 + 0,079 = 1,539 кмоль/ч или 1,539×237 = 364,74 кг/ч. Всего поступает в хлоратор этана: 0,19 + 0,0475 = 0,2375 кмоль/ч или 0,2375×30 = 7,125 кг/ч. Тетрахлорэтилен образуется из этана через 1,1-дихлорэтан по реакции С2Н4 + 5Сl2 ® C2Cl4 + 6HCl (2.34) При этом расходуется хлора: 5×0,2375 = 1,1875 кмоль/ч или 1,1875×71 = 84,31 кг/ч; Образуется: тетрахлорэтилена: 0,2375 кмоль/ч или 0,2375×166 = 39,43 кг/ч; хлороводорода: 6×0,2375 = 1,425 моль/ч или 1,425×36,5 = 52,01 кг/ч. Этилен хлорируется по основной реакции: С2Н4 + 4Сl2 ® C2Cl4 + 4HCl (2.35) При этом расходуется: этилена: 9,19 кмоль/ч или 9,19×28 = 257,32 кг/ч хлора: 4×9,19 = 36,76 кмоль/ч или 36,76×71 = 2609,96 кг/ч; Образуется: тетрахлорэтилена: 9,19 кмоль/ч или 9,19×166 = 1525,54 кг/ч; хлороводорода: 36,76 моль/ч или 36,76×36,5 = 1341,74 кг/ч. Общий расход хлора: 0,36 + 0,18 + 57,52 + 12,44 + 2,125 + 1,003 + 0,553 + 1,1875 + 36,76 – 2,805 » 109,32 кмоль/ч; 25,56 + 12,78 + 4083,92 + 883,24 + 150,87 + 71,213 + 39,263 + 84,31 + 2609,96 – 199,19 = 7761,926 кг/ч. При степени использования хлора 0,85 расход хлора в хлоратор (поток 1) составляет: 109,32/0,85 = 128,61 кмоль/ч или 128,61×71 = 9131,31 кг/ч. Остается хлора в продуктах реакции: 128,61 – 109,32 = 19,29 кмоль/ч или 19,29×71 = 1369,59 кг/ч. Всего образуется хлороводорода: 0,12 + 0,18 + 57,52 + 12,44 + 3,4 + 1,46 + 0,632 + 1,425 + 36,76 = 113,937 кмоль/ч; 4,38 + 6,57 + 2099,48 + 454,06 + 124,1 + 53,29 + 23,07 + 52,01 + 1341,74 = 4158,7 кг/ч. Количество хлороводорода на выходе из хлоратора: 113,937 + 2,36 = 116,297 кмоль/ч или 116,297×36,5 = 4244,84 кг/ч. Количество диоксида углерода на выходе из хлоратора (состав потоков 2 и 3): 0,01 + 0,0475 = 0,0575 кмоль/ч или 0,0575×44 = 2,53 кг/ч. Количество азота на выходе из хлоратора: 0,08 + 0,0475 = 0,1275 кмоль/ч или 0,1275×28 = 3,57 кг/ч. Количество тетрахлорэтилена на выходе из хлоратора: 12,01 + 16,62 = 28,63 кмоль/ч или 28,63×166 = 4752,58 кг/ч. где 12,01 – количество тетрахлорэтилена на входе в хлоратор (рассчитано по составам потоков 4, 5), кмоль/ч; 16,62 – количество образовавшегося тетрахлорэтилена, кмоль/ч. Количество тетрахлорметана на выходе из хлоратора (рассчитано с учетом составов потоков 4-7 и образующегося тетрахлорметана): 9,6 + 17,91 = 27,51 кмоль/ч или 27,51×154 = 4236,54 кг/ч. Составляем материальный баланс хлоратора (табл. 2.1). Таблица 2.1. Материальный баланс хлоратора
· для расчета состава потока 8 используют данные о составе потоков 1-7 2.3.2 Расчет закалочной колонны КЛ1 Исходные данные: степень использования хлора 0,85; количество кубового продукта, подаваемого из колонны выделения тетрахлорэтилена, 85 кг на 1 т перхлоруглеводородов; состав кубового продукта (wi, %): С2Cl4 – 90,0; С2Сl6 – 7,0; C4Cl6 – 2,2; C6Cl6 – 0,8; количество флегмовой жидкости, подаваемой в закалочную колоннуиз емкости сырого тетрахлорметана, 4400 кг на 1 тонну перхлоруглеводородов; состав флегмовой жидкости (wi, %): ССl4 – 60,0; C2Cl4 – 36,0; С2Сl6 – 0,42; C4Cl6 – 0,15; С6Сl6 – 0,05; Cl2 – 2,5; HCl – 0,88. Количество кубового продукта, подаваемого в закалочную колонну из колонны выделения тетрахлорэтилена: 85×5517,24/1000 = 468,96 кг/ч. Состав кубового продукта на входе в закалочную колонну (поток 17):
Количество флегмовой жидкости, подаваемой в закалочную колонну из емкости сырого тетрахлорметана: 4400×5517,24/1000 = 24275,86 кг/ч. Состав флегмовой жидкости на входе в закалочную колонну (поток 18):
Состав подаваемых в закалочную колонну продуктов реакции рассчитывают по составам потоков 9, 17 и 18 (табл. 2.2). Таблица 2.1. Состав продуктов реакции на входе в закалочную колонну
В газовую фазу на выходе из закалочной колонны переходит: практически весь хлор, кроме возвращаемого в хлоратор (поток 5): 27,84 – 0,025 = 27,815 кмоль/ч или 1976,48 – 1,81 = 1974,67 кг/ч; весь азот и диоксид углерода; практически весь хлороводород, кроме возвращаемого в хлоратор (потока 5): 122,147 – 0,05 = 122,097 кмоль/ч или 4458,48 – 1,81 = 4456,67 кг/ч; 94% тетрахлорметана: 0,94×122,09 = 114,76 кмоль/ч или 114,76×154 = 17673,04 кг/ч; 82% тетрахлорэтилена: 0,82×83,823 = 68,73 кмоль/ч или 68,73×166 = 11409,18 кг/ч; 20% гексахлорэтана: 0,2×2,108 = 0,42 кмоль/ч или 0,42×237 = 99,54 кг/ч; 12% гексахлорбутадиена: 0,12×0,919 = 0,11 кмоль/ч или 0,11×261 = 28,71 кг/ч; 10% гексахлорбензола: 0,1×0,553 = 0,06 кмоль/ч или 0,06×285 = 17,1 кг/ч; Доля отгоняемых продуктов реакции (94, 82, 20, 12 и 10%) принята с учетом их температур кипения и молярного состава потока. Рассчитываем состав газовой фазы на выходе из закалочной колонны (табл. 2.3). Таблица 2.3. Состав газовой фазы на выходе из закалочной колонны (поток 10)
Состав кубовой жидкости, отбираемой из закалочной колонны в емкость сырого тетрахлорэтилена, определяют по разности составов потоков на входе в закалочную колонну (табл. 2.2) и газовой фазы на выходе из нее (табл. 2.3). Состав кубовой жидкости на выходе из закалочной колонны (поток 13):
Газовая фаза из закалочной колонны охлаждается и разделяется в сепараторе С1. В газовую фазу на выходе из сепаратора (поток 11) переходит: весь азот и диоксид углерода; 59% хлора из потолка 10 (табл. 2.3): 0,59×27,815 = 16,41 кмоль/ч или 16,41×71 = 1165,11 кг/ч; 93,5% хлороводорода: 0,935×122,097 = 114,16 кмоль/ч или 114,16×36,5 = 4166,87 кг/ч; тетрахлорметана (см. состав потока 7): 0,48 кмоль/ч или 74,48 кг/ч. С целью очитски отходящего хлороводорода в реакторе РТ2 проводят жидкофазное хлорирование этилена хлором, содержащимся в газовой фазе из сепаратора. На улавливание хлора по реакции: С2Н4 +Сl2 ® C2H4Cl2 (2.37) расходуется хлора: 16,41 кмоль/ч или 1165,11 кг/ч. При степени хлорирования этилена 82% (по экспериментальным данным) в реактор необходимо подать этилена: 16,41/0,82 = 20,012 кмоль/ч или 20,012×28 = 560,336 кг/ч. Состав технического этилена на входе в реактор РТ2 (поток 12):
Остается этилена: 19,612 16,41 = 3,202 кмоль/ч или 3,202×28 = 89,656 кг/ч. Образуется 1,2-дихлорэтана: 16,41 кмоль/ч или 16,41×99 = 1624,59 кг/ч. Подают в хлоратор 1,2-дихлорэтана (см. состав потока 7): 14,11 кмоль/ч или 1397,23 кг/ч. Поступает 1,2-дихлорэтана в абсорбер хлороводорода: 16,41 – 14,11 = 2,3 кмоль/ч или 227,36 кг/ч. В жидком 1,2-дихлорэтане, поступающем в хлоратор: растворено хлороводорода: 0,49 кмоль/ч или 17,88 кг/ч; уходит в абсорбер хлороводорода: 114,16 – 0,49 = 113,67 кмоль/ ч или 4166,87 – 17,88 = 4148,99 кг/ч. Составляют Материальный баланс реактора РТ2 (табл. 2.4). Определяем состав жидкой фазы из сепаратора С1 (поток 14), поступающей в емкость сырого тетрахлорметана, по разности составов потоков 10 и 11. Состав жидкой фазы из сепаратора С1 (поток 14):
Состав сырца перхлоруглеводородов, поступающего из емкостей для хранения сырых перхлоруглеводородов в колонну отпарки сырца (поток 19) определяют по разности составов поступающих потоков 13 и 14 и выходящих потоков 5 и 18. Таблица 2.4. Материальный баланс реактора РТ2
Состав сырца перхлоруглеводородов на входе в колонну отпарки (поток 19):
Состав сырца, передаваемого из колонны отпарки на стадию выделения чистых перхлоруглеводородов, определяют по разности составов потоков 19 и 6. Состав сырца перхлоруглеводородов, передаваемого на стадию выделения чистых перхлоруглеводородов (поток 20):
Составляем материальный баланс стадии получения перхлоруглеводородов (табл. 2.5). Таблица 2.5. Материальный баланс стадии получения перхлоруглеводородов
Расчет основных расходных коэффициентов. Для получения 5517,24 кг/ч перхлоруглеводородов (отношение ССl4:C2Cl4 = 1:1) необходимо: 9131,31 кг/ч хлора; 832,261 кг/ч технического этилена; 79,42 кг/ч природного газа (см. табл. 2.5). Расходные коэффициенты составят: по хлору: 9131,31/5517,24 = 1,655 т/т; по техническому этилену: 832,261×1000/5517,24 = 150,85 кг/т; по природному газу: 79,42×1000/5517,24 = 14,39 кг/т. 2.3.3 Тепловой расчет хлоратора Исходные данные: материальные потоки (см. состав потоков 2-7): хлор – 128,61/(2×3600) = = 0,0179 кмоль/с; природный газ – 4,72/(2×3600) = 0,0007 кмоль/с; технический этилен - 9,38/(2×3600) = 0,0013 кмоль/с; жидкие хлоруглеводороды - 386,21/(2×3600) = = 0,0536 кг/с; жидкие рециркулирующие перхлорутлеводороды из емкостей сырого продукта 3613,64/(2×3600) = 0,502 кг/с; продукты отпарки сырца перхлоруглеводородов - 4,93/(2×3600) = 0,0007 кмоль/с; жидкий 1,2-дихлорэтан 1489,59/(2×3600) = = 0,2069 кг/с; температура потоков, °С: хлор, природный газ, технический этилен - 25; хлоруглеводороды и рецикл (сырой продукт) - 20; продукты отпаркп сырца перхлоругдеводородов - 30; продукты реакции - 585. Цель расчета - определение количества теплоты, отводимой охлаждающей водой. Уравнение теплового баланса хлоратора в общем виде: Ф1 + Ф2 + Ф3 + Ф4 + Ф5 + Ф6 = Ф7 + Ф8 + Ф9 + Фпот, (2.38) где Ф1, Ф2, Ф3, Ф4, Ф8 – тепловые потоки газообразного сырья (хлор, природный газ, технический этилен), жидких хлоруглеводородов, жидких рециркулирующих перхлоруглеводородов, жидкого техническго 1,2-дихлорэтана и продуктов реакции соответственно, кВт; Ф6 – теплота экзотемической реакции, кВт; Ф7 – теплота, расходуемая на испарение жидких компонентов сырьевой смеси, кВт; Ф9 – теплота, отводимая охлаждающей водой, кВт; Фпот теплопотери в окружающую среду, кВт. Определяем тепловые потоки сырья и продуктов. Значения теплоемкостей находим по /7/ (Приложения, табл. 2-4). Тепловой поток газообразного сырья (потоки 1-3): Ф1 =(0,0179×33,93 + 0,0007×35,71 + 0,0013×43,56)×25 = 17,22 кВт. Тепловой поток жидких хлоруглеводородов (поток 4): Ф2 = (0,0536/100)×(1,289×7,0 + 0,962×4,2 + 0,858×6,0 + 0,950×5,5 + 0,862×77,3)×20 = = 0,97 кВт. Тепловой поток жидких рециркулирующих перхлоруглеводородов (поток 5): Ф3 = (0,502/100)×(0,858×70,8 + 0,862×29,2)×20 = 8,63 кВт. Тепловой поток продуктов отпарки сырца перхлоруглеводородов (поток 6): Ф4 = (0,0007/100)×(0,545×154×6,75 + 34,13×55,75 + 29,11×37,5)×30 = 0,75 кВт. где 0,545 – удельная теплоемкость паров тетрахлорметана, кДж/(кг×К); 154 – молярная масса тетрахлорметана, г/моль. Для упрощения расчета все компоненты, присутствующие в потоке 7, объединены в поток «дихлорэтан». Тепловой поток жидкого 1,2-дихлорэтана (поток 7): Ф5 = 0,2069×1,289×20 = 5,334 кВт. Рассчитываем теплоты реакций (в кДж/моль):
Теплота экзотермических реакций (теплота реакции образования гексахлорбутадиена принята равной теплоте реакции образования гексахлорбензола): Ф6 = [1000/(2×3600)]×[285,62×0,12 + 91,48×0,18 + 694,98×7,19 + 394,81×3,11 + + 1996,3×(0,14 + 0,09) + 730,2×0,079 + 484,25×0,2375 + 436,6×9,19] = = [1000/(2×3600)]×10919,69 = 1516,52 кВт. Общий приход теплоты: Фприх = 17,22 + 0,97 + 8,63 + 0,75 + 5,334 + 1516,52 = 1549,424 кВт. Количество веществ испаряющихся в хлораторе (кг/ч): тетрахлорметан - 298,54 + 1055,18 + 74,48 = 1428,2; тетрахлорэтилен – 23,17 + 1971,24 = 1994,41; гексахлорэтан – 346,91; гексахлорбуталдиен 169,84; гексахлорбензол – 66,85; трихлорэтилен – 16,23; трихлорметан – 21,24; 1,2-дихлорэтан – 27,03 + 1397,23 = 1424,26. Определяем теплоту, расходуемую на испарение жидких компонентов. Значения теплот испарения компонентов по /7/ (Приложения, табл. 9) теплоты испарения гексахлорбутадиена и гексахлорбензола приняты равными теплоте испарения гексахлорэтана: Ф7 = [1/(2×3600)]×[1428,2×194,7 + 1994,41×209,2 + (346,91 + 169,84 + 66,85)×215,5 + + 16,23×239,3 + 21,24×248,3 + 1424×323,4] = 1164980,4/(2×3600) = 161,8 кВт Тепловой поток продуктов реакций (поток 9; с целью упрощения расчета в поток «тетрахлорэтилен» включены гексахлорбензол, гексахлорбутадиен, гексахлорэтан, а в поток «хлор» - азот, диоксид углерода и хлороводород): Ф8 = [1/(2×3600)]×[(4752,58 + 105,45 + 193,14 + 364,74)×0,693 + 4236,54×0,656 + + (1369,59 + 3,57 + 2,53)×(37,21/71) + 4244,84/(30,63/36,5)]×585 = [10815,55/(2×3600)]× ×585 = 878,76 кВт. Принимаем, что теплопотери в окружающую среду составляют 5% от общего прихода теплоты: Фпот = 0,05×1549,424 = 77,47кВт. Количество теплоты, отводимое охлаждающей водой, находят из уравнения теплового баланса хлоратора: Ф9 = Фприх Ф7 – Ф8 – Фпот = 1549,424 – 161,8 – 878,76 77,47 = 431,394 кВт или 431394 Вт. Рассчитывают расход воды на охлаждение наружной стенки хлоратора. Принимают начальную температуру воды tH = 20°С и считают, что в процессе теплообмена температура повысилась на 20°С, тогда расход воды составит: mB = Ф9/(сВ×Δt×η) = 431394/(4187×20×0,9) = 5,7239 кг/с. ЗАКЛЮЧЕНИЕ 1. Изучены способы и технологии получения тетрахлорметана и тетрахлорэтилена, области их применении, используемая реакционная аппаратура и рассмотрены материалы, которые целесообразно использовать в процессах хлорирования. 2. Рассмотрен химизм получения тетрахлорметана и тетрахлорэтилена. 3. Разработана и описана технологическая схема процесса совместного получения тетрахлорметана и тетрахлорэтилена. 4. Выполнены материальные расчеты стадии получения тетрахлорметана и тетрахлорэтилена и Теловой расчет хлоратора. Расходные коэффициенты на годовую производительность по перхлоруглеводородам составляют: по хлору: 9131,31/5517,24 = 1,655 т/т; по техническому этилену: 832,261×1000/5517,24 = 150,85 кг/т; по природному газу: 79,42×1000/5517,24 = 14,39 кг/т. СПИСОК ИСПОЛЬЗОВАННОЙ ЛИТЕРАТУРЫ 1. Лебедев Н.Н. Химия и технология основного органического и нефтехимического синтеза. – М.: Химия, 1981. 2. Адельсон С.В., Вишнякова Т.П., Паушкин Я.М. Технология нефтехимического синтеза. – М.: Химия, 1985. 3. Справочник нефтехимия / Под ред. С.К. Огородникова. В 2-х т. – Л.: Химия, 1978. 4. Капкин В.Д., Савинецкая Г.А., Чапурин В.И. Технология органического синтеза. – М.: Химия, 1988. 5. Трегер Ю.А., Гужновская Т.Д. Интенсификация хлорорганических производств. Высокоэффективные каталитические системы. – М.: Химия, 1989. 6. Муганлинский Ф.Ф., Трегер Ю.А., Люшин М.М. Химия и технология галогенорганических соединений. – М.: Химия, 1993. 7. Гутник С.П., Сосонко В.Е., Гутман В.Д. Расчеты по технологии органического синтеза. – М.: Химия, 1988. 8. СТП 001-2002 Стандарты предприятия. Проекты (работы) дипломные. Требования и порядок подготовки, представления к защите и защиты. – Мн.: БГТУ, 2002. |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
| 17.06.2012 |
| Большое обновление Большой Научной Библиотеки |
| 12.06.2012 |
| Конкурс в самом разгаре не пропустите Новости |
| 08.06.2012 |
| Мы проводим опрос, а также небольшой конкурс |
| 05.06.2012 |
| Сена дизайна и структуры сайта научной библиотеки |
| 04.06.2012 |
| Переезд на новый хостинг |
| 30.05.2012 |
| Работа над улучшением структуры сайта научной библиотеки |
| 27.05.2012 |
| Работа над новым дизайном сайта библиотеки |

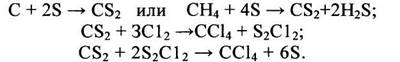 (1.1)
(1.1)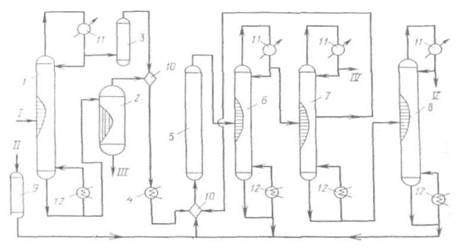
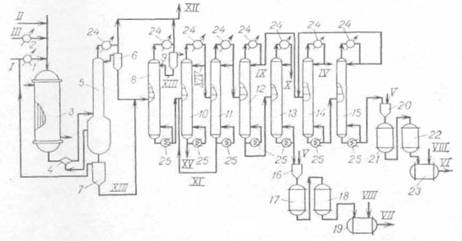
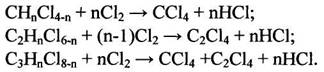 (1.12)
(1.12)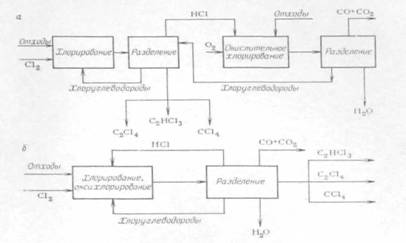
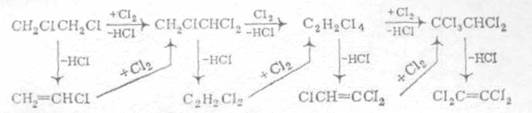 (1.13)
(1.13)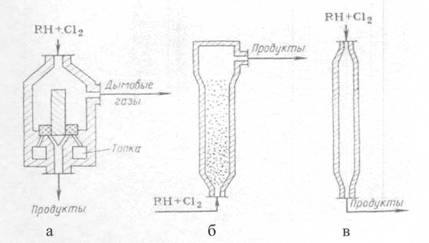
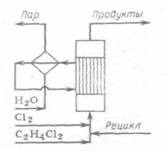
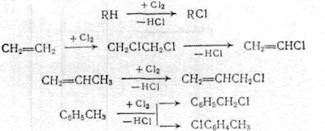 (2.1)
(2.1)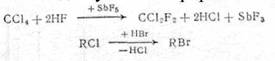 (2.2)
(2.2)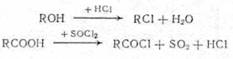 (2.3)
(2.3)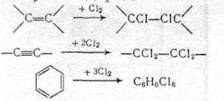 (2.4)
(2.4)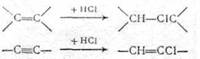 (2.5)
(2.5)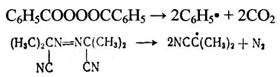 (2.17)
(2.17)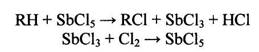 (2.19)
(2.19)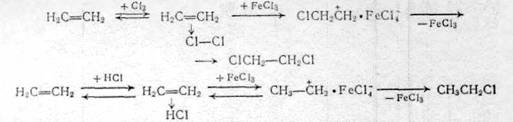 (2.22)
(2.22)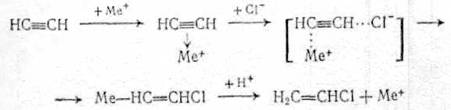 (2.25)
(2.25)